8%

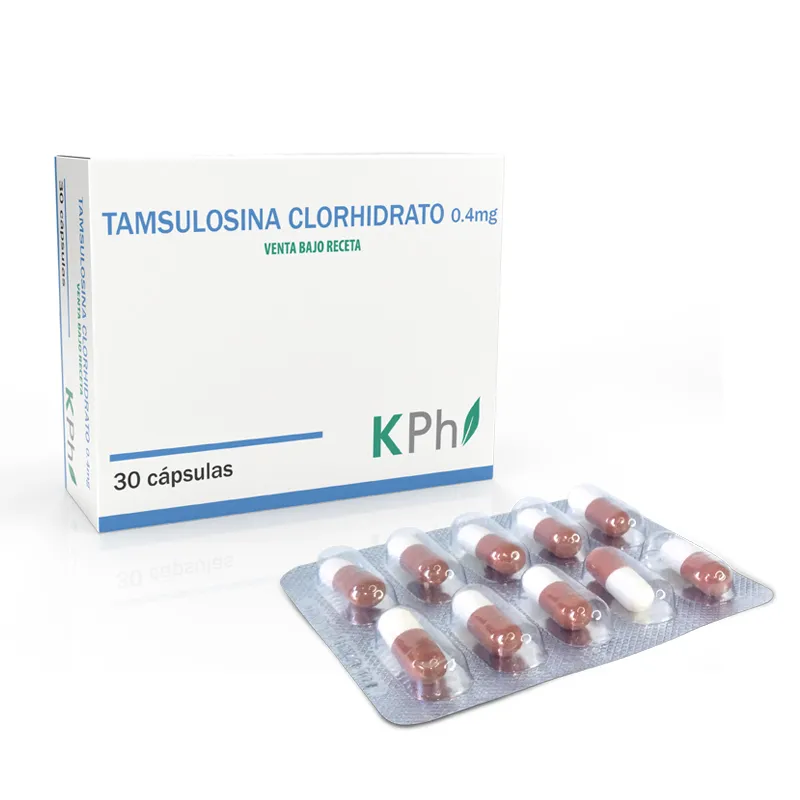
Donabella Drospirenona 3,0 mg - Caja de 21 Comprimidos Recubiertos
Código: 974777841134008851
Retiro de sucursal
Entrega delivery
RegularGs. 77.000
-8% de descuento
Con descuentoPrecio exclusivo para compras vía Web.
Gs. 70.840Descripción
También te podría interesar
También te podría interesar