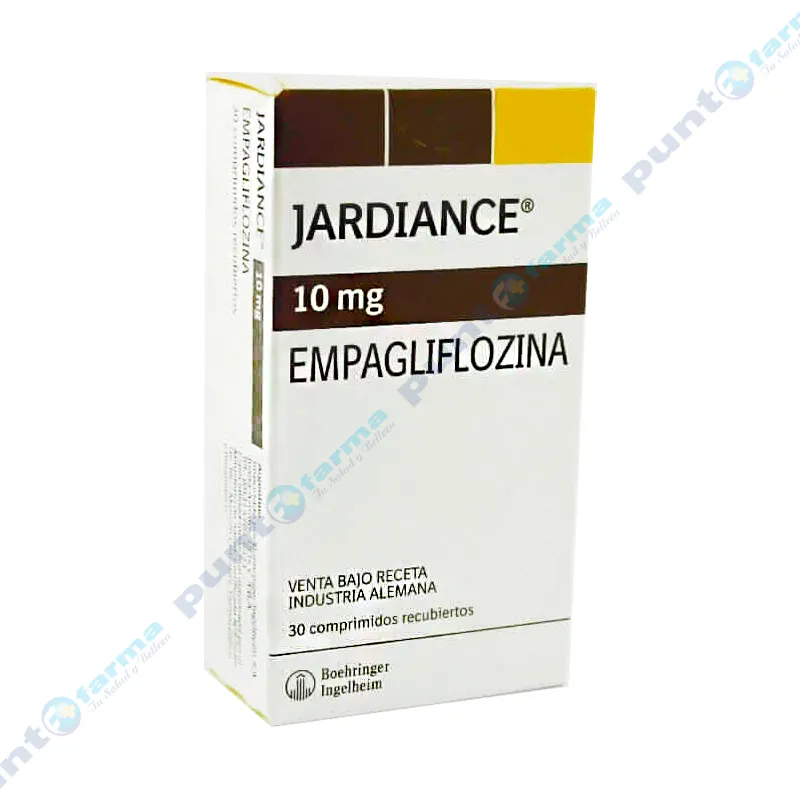
Jardiance Empagliflozina 10mg - Caja de 30 Comprimidos Recubiertos
Código: 1738384048846021250
Retiro de sucursal
Entrega delivery
RegularGs. 377.389
-8% de descuento
Con descuentoPrecio exclusivo para compras vía Web.
Gs. 347.198Descripción
También te podría interesar
También te podría interesar