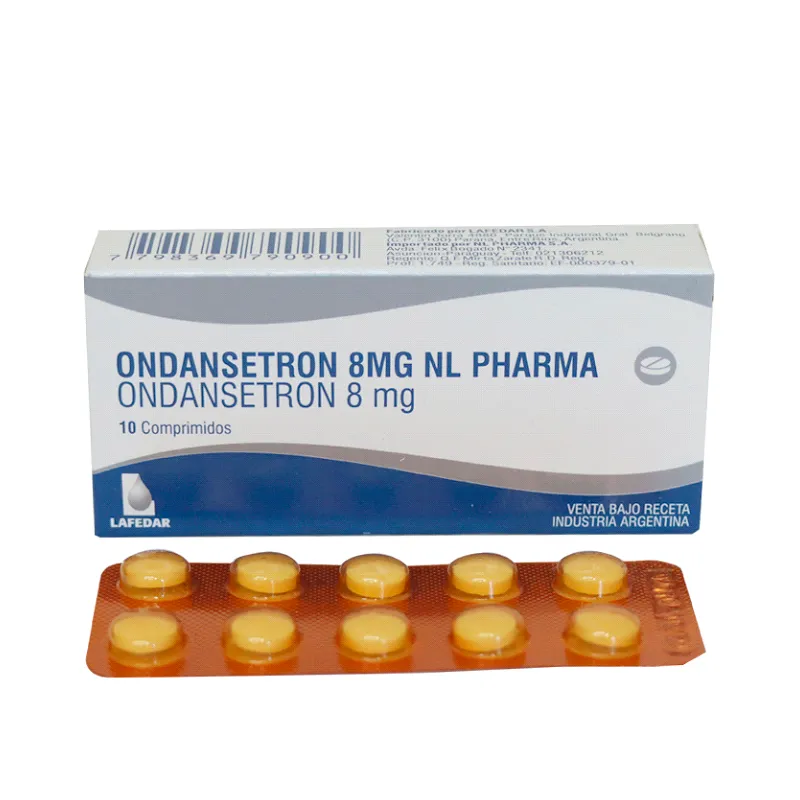
Melteon Ondansetron de 8 mg - Caja con 10 comprimidos sublinguales
Código: 1132287840213254738
Retiro de sucursal
Entrega delivery
RegularGs. 95.000
-14% de descuento
Con descuentoPrecio exclusivo para compras vía Web.
Gs. 81.700Descripción
También te podría interesar
También te podría interesar